RÉSUMÉ : Les tumeurs glomiques ou glomangiomes, sont des tumeurs bénignes issues des corps glomiques : thermorégulateurs péri vasculaires. Elles se localisent le plus souvent dans la région péri- unguéale. Rares, représentent entre 1-5% de l’ensemble des tumeurs des PM de la main, concernent la femme entre 30 et 50ans. Le délai Dg varie entre 3et 7 ans en raison du caractère atypique des signes cliniques. L’exérèse chirurgicale complète est le traitement de référence.
Nous présentons les aspects cliniques, radiologiques, et thérapeutiques de cette entité peu connue, et soulignons l’intérêt du traitement chirurgical, mais la voie d’abord reste controversée.
Mots clés : Tumeurs glomiques, Gangliomes, Tissus vasculaires, Main.
ABSTRACT : Glomus tumors, or glomangiomas, are benign tumors originating from glomic bodies: peri-vascular thermo-regulators. They are most often located in the periungual region. Rare, representing between 1-5% of all PM hand tumors, affect women between 30 and 50 years of age. The diagnostic time varies between 3 and 7 years due to the atypical nature of the clinical signs. Complete surgical excision is the standard treatment.
We present the clinical, radiological, and therapeutic aspects of this little-known entity, and highlight the value of surgical treatment, but the approach remains controversial.
Key words : Glomus tumors, Glomangiomas, Vascular tissues, Hand.
INTRODUCTION
La tumeur glomique de Masson est une tumeur bénigne [1] de la jonction dermo-hypodermique dénommée hamarthome [2, 3] elle correspond à une prolifération neuro-myo-artérielle [4] intervenant dans la microcirculation et la régulation thermique [5]. C’est une tumeur rare [6] qui représente 1- 5% [7, 8] de l’ensemble des tumeurs des parties molles de la main, avec un tropisme particulier pour l’appareil unguéal [9] où on lui reconnait deux sites de prédilection : le lit de l’ongle et la région matricielle [10, 11].
La prédominance féminine est nette [12], survenant entre 30 -50 ans. Souvent méconnues [13, 14] en raison de la pauvreté des signes cliniques [15], en dehors de la symptomatologie douloureuse [16, 10] rapportée par les patientes, responsable d’un délai diagnostic qui varie entre 3 et 7 ans [16, 17].
Décrites par Wood en 1882 [18], l’origine glomique lui a été attribuée grâce au travail magistral de Masson en 1924 [4].
Le traitement, chirurgical [19,20] consiste en une exérèse complète et minutieuse tout en évitant la dystrophie de l’ongle, la voie d’abord controversée est sujette à discussion [21, 22].
La récidive est rare (7%) [14], souvent liée à une exérèse incomplète, ou à des localisations multiples [23, 24].
PATIENTS ET METHODE
Le diagnostic de certitude repose sur unradiologiques,faisceau d’argumentsmaisseulel’histologieclinques estet fiable.
La douleur est le maitre symptôme, l’élément constant, elle reste le principal motif de la consultation [25], exacerbée à la pression des doigts et au froid [26].
A l’inspection on retrouve dans près d’un tiers des cas une zone rouge violacée, ou une voussure rosée sous l’ongle (Fig. 1) [27].
A l’examen, la douleur est mise en évidence par la mine d’un crayon déclenchant une algie syncopale : c’est le Pin test ou test de love (Fig. 2) [28] caractérisé par sa grande sensibilité (92-100%) [2]. Cette douleur va disparaitre après la pause d’un garrot, réalisant une ischémie digitale de l’ordre de 15 à 30 secondes : c’est le test d’Hildreth [29] spécifique, fortement évocateur voire pathognomonique.
L’imagerie est utile du fait des difficultés diagnostic et de la symptomatologie non spécifique [30]. La radiologie est peu évocatrice, elle permet d’éliminer une exostose [31, 14] ou un ostéome osteoïde.
L’érosion régulière de la houppe est le signe le plus fréquent 30% [19, 10] sous forme d’une encoche aux contours festonnés (70%) dénommée scaloping (Fig. 3) qui correspond à l’empreinte de la tumeur avec épaississement du lit de l’ongle [16].
L’échographie, examen accessible, reproductible, permet le diagnostic aves une sensibilité de 70% [32] mais elle reste incompétente pour les tumeurs inferieures
à 3 mm. Le glomangiome apparait alors sous forme d’une image hypo échogène, homogène, non calcifiée [2, 33] bien limitée, avec de nombreux shunts intra -tumoraux lorsqu’elle est couplée au doppler pulsé [32]. La douleur caractéristique est provoquée lors du passage de la sonde. Cet examen non invasif est également utile dans le suivi post-opératoire [34].
La TDM n’a que très peu d’indications, en dehors des rares cas où le diagnostic d’ostéome est soulevé, elle peut aider à la réalisation d’une biopsie, notamment dans les formes extra-digitales, mais ne constitue en aucun cas un outil essentiel au diagnostic. L’IRM, examen de référence, permet une approche DG non invasive, en haute résolution la tumeur est en hypo signal en T1 avec fort rehaussement en T2 [35, 36] et excellente corrélation anatomo – chirurgicale [37], sa spécificité est de 86% [36]. Elle trouve son indication dans localisations s/unguéales et surtout dans la détection des récidives [38].
Notre série, rétrospective mono centrique, est constituée de 23 cas opérés entre 2000-2010, la prédominance féminine est quasi absolue, notre recul est de 50 mois.
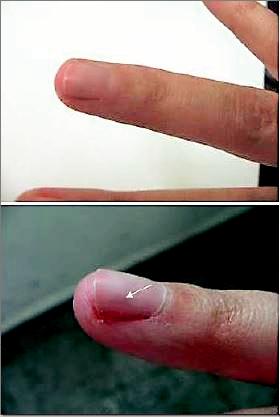
Fig. 1 : Voussure rosée sous l’ongle.

Fig. 2 : Pin test ou Test de Love.
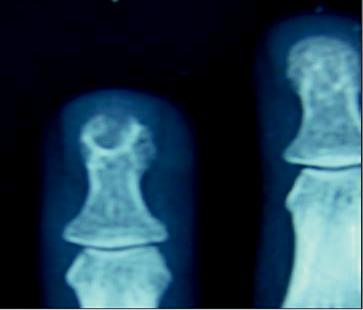
Fig. 3: Signe du Scalloping sur une radiographie standard.
TECHNIQUE OPERATOIRE
la majorité des tumeurs étant sous unguéales, directe[39,notre40]. voie On réalise d’abord une st lambeau latérale formé(Fig.4) par[41]l aberge où l’exposition cutanée et le litest de large, l’ongle la dissection l’ongle et est laaisée ,jonction il faut respecter matricielle le litende soulevant dissociant du le Périoste, complexele un guéal, lever mon oblocen le de une l’ongle formation de son pourprelitmetdonten évidence l’aspect macroscopique après excision de la zone pathologique est celui d’un nodule rose ou rouge violacé, encapsulé, bien limité, infra centimétrique (Fig. 5) [42, 30, 37].
Enfin un fin curetage est utile, éliminant le reliquat tumoral, il trouve son intérêt dans la prévention des récidives.
La lame unguéale est repositionnée protégeant le site opératoire [14, 43].
La confirmation diagnostic est apportée par la présence de cellules glomiques : cellules epitheloides associées à des structures musculaires lisses et vasculaires organisées en travées (Fig. 6) [44, 28, 29].
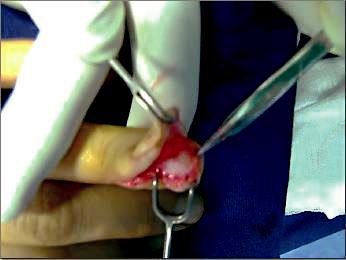
Fig. 4: Abord latéral, lambeau formé par la berge cutanée et le lit de l’ongle.
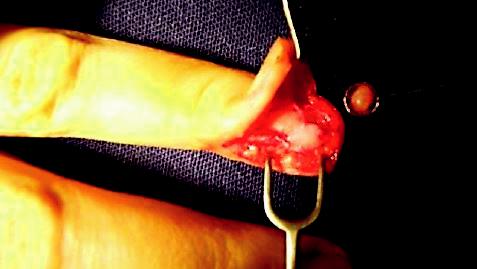
Fig. 5 : Excision de la tumeur encapsulée.
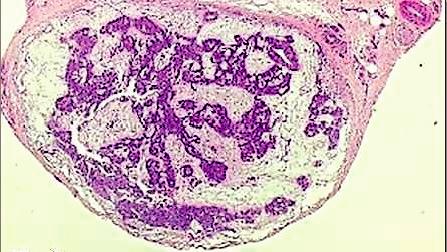
Fig. 6 : Aspect anatomopathologique.
Les suites opératoires étaient simples, notre stratégie était curative et a permis d’excellents résultats avec disparition spectaculaire de la douleur, ainsi qu’un aspect cosmétique correct sans récurrences (Fig. 7).
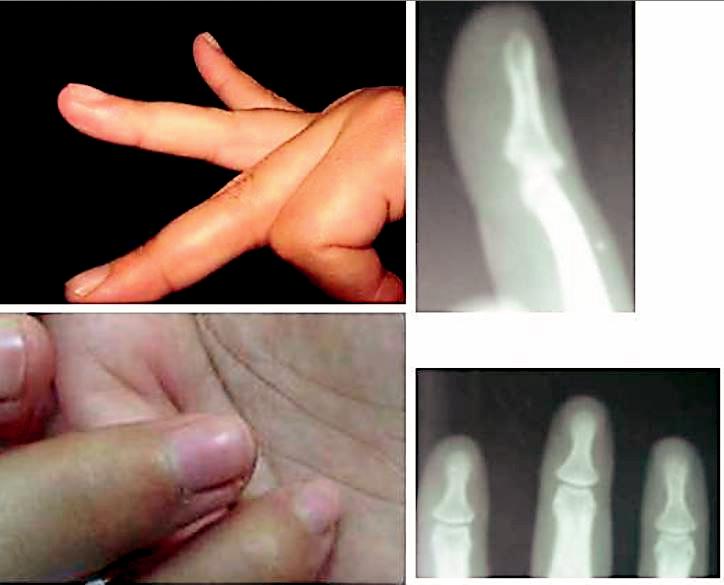
Fig. 7 : Résultat en 4 mois post-opératoire.
Au recul moyen de 50 mois les douleurs ont totalement disparu. Quant à la récidive, rare [14], elle est tardive, présente chez une patiente, elle peut être la conséquence d’une exérèse incomplète, ou à des localisations multiples [23,24] très peu connues, transmises selon le mode autosomique dominant, elles représentent 10% parfois associées à une neurofibromatose. [45]
DISCUSSION
La tumeur glomique correspond à une prolifération neuro-myo-artérielle de la jonction dermo-hypodermique, riche en anastomoses artério-veineuses.
Les sites de prédilection sont la région sous unguéale [46] et face latérale des doigts qui représentent 65%, tandis que les variétés pulpaires sont plus rares [47,37], les localisations extra- digitales sont peu connues caractérisées par une grande taille, décrites au fémur [48], au creux poplité [49, 42] au pied [50] à l’estomac [51], ainsi qu’à l’utérus [52]. Le diagnostic clinique est évoqué devant une douleur fulgurante, spontanée, inclue dans la triade caractéristique de Carroll [16] : douleur paroxystique, douleur à l’effleurement, douleur au froid la plus spécifique.
L’étiologie précise est indéterminée, où aucune corrélation n’est retrouvée avec le traumatisme pourtant souvent incriminé.
L’IRM facilite l’approche chirurgicale qui reste le traitement de référence, elle optimise en outre la VA toujours controversée [24, 25] entre abord latéral préconisé par Iselin [40] dans les variétés latérales, où la dystrophie est inexistante [53], et l’abord Trans-unguéal [54, 55] qui impose des procédés micro-chirurgicaux afin de restaurer l’appareil unguéal où la repousse est plus longue, avec gêne prolongée, vision peropératoire étroite. Pour notre part, la voie d’abord latérale [40] nous semble moins délabrante, elle autorise une tumorectomie complète par une large exposition tout en respectant l’ongle et la jonction matricielle. Quant au Dg différentiel, [56] il est vaste et reste facilité par l’examen clinique, tel que :
– Le kyste mucoïde qui ne se rehausse pas à l’IRM.
– L’hémangiome avec les mêmes caractéristiques à l’IRM, mais siégeant au niveau de l’épiderme.
– Le neurinome sans signes vasculaires à l’IRM, sans sensibilité au froid.
– Le mélanome indolore [57].
– L’ostéome osteoïde où l’aspect radiologique de l’image en cocarde (lacune entourée d’une sclérose) reste évocatrice.
Quant à La transformation sarcomateuse maligne est exceptionnelle [58, 59, 60], elle devra être évoquée devant une tumeur de grande taille.
CONCLUSION
Les tumeurs glomiques de Masson correspondent à une prolifération NMA, rares et bénignes.
C’est une pathologie déroutante de la femme jeune [12], dont le siège de prédilection est la région tactile des doigts qui se manifeste par des douleurs lancinantes et un phénomène de Raynaud inconstant mais fortement évocateur.
Le délai diagnostic varie entre 3 et 7 ans dans les formes digitales [61] et de 7 à 10 ans [62, 63] dans les localisations extra-digitales, en raison de la méconnaissance de cette pathologie du fait du non utilisation de l’IRM injecté qui reste l’examen de référence permettant un bilan topographique et morphologique précis de la lésion.
L’exérèse chirurgicale simple, minutieuse autorise une résolution immédiate et définitive [22, 23] de la symptomatologie douloureuse, mais la voie d’abord est loin de faire l’unanimité, nous préconisons la voie latérale pour sa simplicité, son innocuité, sa qualité d’exposition.
Les auteurs déclarent ne pas avoir de conflit d’intérêts.
BIBLIOGRAPHIE
[1] FOLPE AL, FANBURG-SMITH JC,
MIETTINEN M, WEISS SW. Atypical and malignant glomus tumors: analysis of 52 cases, with a pro- posal for the reclassification of glomus tumors. Am j surg pathol 2001;25:1-12.
[2] FRIKH R, ALIOUA Z, HARKET A, ET AL. Glomus tumors: anatomo clinical study of 14 cases with literature review. Ann chir plast esthet 2009 ; 54 : 51-6.
[3] SOULE EH, GHORMLEY RK, BULBULIAN AH. Primary tumors of the soft tissues of the extremities exclusive of epithelial tumors : an analysis of five hundred consecutive cases. Ama arch surg 1955;70:462–74.
[4] MASSON P. Le glomus neuro myoartériel des régions tactiles et Ses tumeurs. Lyon chir 1924;21:257—80.
[5] SORENE ED, GOODWIN DR. Magnetic resonance imaging of a tiny glomus tumour of the fingertip: a case report. Scand j plast reconstr surg hand. Surg 2001;35(4):429–31.
[6] RAIMBEAU G, MALLET J,
FONDIMARE A, TIROUFLET D. Tumeurs glomiquesdes doigts (à propos de 6 cas personnels). Ann orthop Ouest 1984; 16:85.
[7] GLICENSTEIN J, OHANA J, LECLERCQ C. Tumeurs de la main. Berlin: Springer verlag; 1988, p. 143-9.
[8] VANDEVENDER DK, DALEY RA. Benign and malignant vascular Tumors of the upper extremity. Hand clin 1995; 11:161-81.
[9] VASISHT B, WATSON HK, JOSEPH ET AL. Digital glomus tumors: a 29-year experience with a lateral sub periosteal approach. Plastreconstr surg. 2004 ; 114 (6) : 1486-9.
[10] VAN GEERTRUYDEN J, LOREA P,
GOLDSCHMIDT D ET AL. Glomustumours of the hand: a retro spective study of 51 cases. J hand surg br.1996;21:257-60.
[11] BUREAU H, JOUGLARD PJ,
THION A, TRAMIER H,
PIERRE M. Tumeurs Glomiques. In: l’ongle. Monographie du g.e.m. paris: expansion Scientifique française; 1978, p. 102-6.
[12] CLARK ML, O’HARA C, DOBSON PJ, ET AL. Glomus tumor and knee pain: a report off our cases. Knee 2009; 16:231-4.
[13] DOMÍNGUEZ CHERIT J,
CHANUSSOT DEPREZ C, VEGA
MEMIJE E, LUIS MONTOYA P. Tumeurs de l’appareil unguéal. Expérience du Service de dermatologie de l’hôpital général « dr manuel Gea gonzález » à méxico. Ann dermatol Venerol 2006;133(no 2):182.
[14] FOUCHER G, LE VIET D, DAILIANA Z, PAJARDI G. Les tumeurs glomiques de la région unguéale. Rev chir orthop 1999; 85:362-6.
[15] MANSAT M, BONNEVIALLE P, GAY R, URROUX R. Tumeurs glomiques pauvrete clinique De la main. À propos de quatorze cas. Ann chir main 1985;4:43-50.
[16] CARROLL RE, BERMAN AT. Glomus tumors of the hand: review of
The literature and report on twenty-eight cases. J bone joint Surg 1972 ; 54a 691-703.
[17] WAHBI S, BELKOURCHIA E,
BOUHOUCH A, ELKHARRAZI M, Glomus tumor in the quadriceps ligament: a case report. Rev chir orthop Reparatrice appar mot 2005;91(3):272–5.
[18] WOOD W. Painful subcutaneous tubercle. Edinb med j 1812; 8:283.
[19] HAZANI R, HOULE JM, KASDAN ML, WILHELMI BJ. Glomus tumors of the hand. Eplasty 2008;8:e48.
[20] LEE IJ, PARK DH, PARK MC, PAE NS. Subungual glomus tumours of the hand : Diagnosis and outcome of the transungual approach. J hand surg Eur 2009 ; 34 (5) : 685–8.
[21] COGREL O, THOMAS L. Chirurgie
unguéale. In: chirurgie dermato-
logique. Amici et coll., Elsevier Masson
Sas ; 2011.
[22] MURAMATSU K, IHARA K,
HASHIMOTO T, TOMINAGA Y, TAGUCHI T.subungual glomus tumours : diagnosis and microsurgical excision through a lateral subperiostal approach. J plast reconstr aesthsurg 2014 ; 67 : 373-6.
[23] MOOR EV, GOLDBERG I, WESTREICH M. Multiple glomus tumor : a case report and review of the literature. Ann plast surg 1999 ; 43 : 436-8.
[24] NOOR MA, MASBAH O. Synchronous glomus tumors in a distal digit : A case report. J hand surg 1997 ; 22a : 508-10.
[25] RODRIGUEZ JM, IDOATE MA, PARDO-MINDAN FJ. The role of mast cells in glomustumours: report of a case of an intramuscular glomustumour with a prominent mastocytic component. Histopathology. 2003 ; 42 : 307-8.
[26] LEE CH, BYEON JH, RHIE JW ET AL. Clinical analysis of twenty cases of glomus tumor in the digits. J korean socplastreconstr surg.1995;22:169-78.
[27] BARAN RL, DAWBER RR. Les traitements chirurgicaux : tumeur Glomique. In: guide médicochirurgical des onychopathies. Voussure Paris: arnette blackwell; 1995, p. 78.
[28] LOVE JG. Glomus tumors: diagnosis and treatment. Proc staff Meet mayo clin 1944;19:113—6.
[29] HILDRETH DH. The ischemia test for glomus tumor: a new diagno[stic test rev surg 1970;27:147–8.
[30] BELKOURCHIA E, WAHBI S, BELLARBI S, MOUSTAINE R, ELMANOUAR M. Tumeur glomigue à localization inhabituelle. Rev maroc chir Orthop traumato 2005;24:44—5.
[31] PONNELLE T, GOUNY P, BOUDGHÈNE F, LE BRETON C, BIGOT J-M, CALLARD P, ET AL. Tumeur glomique des extrémités. J mal vasc 1999; 24:364-7.
[32] MARCHADIER A, COHEN M, LEGRÉ R. Tumeurs glomiques sous-unguéales des doigts : diagnostic échographique. Chir main 2006 ; 25 : 16–21.
[33] GÓMEZ-SÁNCHEZ ME, ALFAGEME-ROLDÁN F, ROUSTÁN-GULLÓN G, ET AL. The useful-ness of ultrasound imaging in digital and extradigital glomus tumors. Actasdermosifiliogr 2014;105:e45–9.
[34] MOON ES, CHOI MS, KIM MS ET AL. Distribution of glomus tumors in fingers. J korean socsurg hand. 2009 ; 14 : 138-43.
[35] SCHIEFER TK, PARKER WL, ANAKWENZE OA, AMADIO PC, INWARDS CY, SPINNER RJ. Extradigital glomus tumors: a 20-year experience. Mayo clinic proc 2006; 81:1337-44.
[36] DRAPÉ JL, IDY PERETTI I, GOETTMANN S, GUÉRIN-SURVILLE H, BITTOUN J. Standard and high resolution magnetic resonance imaging of glomus tumors of toes and fingertips. J am acad dermatol 1996 ; 35 550-5.
[37] DUPUIS P, PIGEAU I, EBELIN M, BARBATO B, LEMERLE JP. Apport de l’IRM dans l’exploration des tumeurs glomiques. Ann chir main memb super 1994; 13:358–62.
[38] BENNANI KM, ELKHADIM K, LAMRANI MO, ELBARDOUNI A, BERRADA MS, ELYACOUBI M. Tumeurs glomiques des doigts : approche diagnostique Et thérapeutique (à propos de 12 cas). Rev maroc chir Orthop traumato 2009;40:19.
[39] BOUKHRIS J, MARGAD O, BENCHAKROUNE M, BOUSSOUGA M, ZADDOUG O, ETTAI T, ET AL. Diagnostic et traitement chirurgical des Tumeurs
glomiques de la main (à propos de 10 cas). Rev maroc Chir orthop traumato 2008;35:14—8.
[40] ISELIN M. La voie d’accès latéro-pulpaire dans les tumeurs glomiques de Doigts. In: pierre m. (ed.). Paris:l’ongl expansion scientifique française, 1978: p.107. Traumato 2008;35:14—8.
[41] HORST F, NUNLEY JA.. Glomus tumors in the foot: a new surgical Technique for removal. Foot and ankle int 2003;24:949—52.
[42]. LEKHAL B, LAHTAOUI A,
MEKOUAR T, ELMESNAOUI A, BENJELLOUN A, AMMAR F, BENSAID Y, BENYAHIA B : glomogiome Du creux poplite : à propos d’un cas. J chir, 1997, 134, 436-437.
[43] MOON SE, WON JH, KWON OS, KIM JA. Subungual glomus tumor : Clinical manifestations and outcome of surgical treatment. Jdermatol 2004 ; 31:993-7.
[44] MOREY VM, GARG B, KOTWAL PP (2016) glomus tumours of the Hand: review of literature. J clin orthop trauma 7:286–91
[45] STEWART DR, SLOAN JL, YAO L,
MANNES AJ, MOSHYEDI A, LEE CC, ET AL. Diagnosis, management, and complications of glomus Tumours of the digits in neurofibromatosis type 1. J med genet 2010;47:525—32.
[46] MCDERMOTT EM, WEISS AP. Glomus tumors. J hand surg am 2006;31:1397-400.
[47] JAMARI S, AARON GP, SHALIMAR A. Glomus tumor in the second Toe: a clinical insight. J foot ankle surg 2008;47:483—6.
[48] GONZALEZ-LLANOS F, LOPEZ-
BAREA F, ISLA A, FERNANDEZ-PRIETO A, ZUBILLAGA A, ALVAREZ F. Periosteal glomus tumor of the femur: a Case report. Clin orthop 2000;380:199—203.
[49] AMILLO S, ARRIOLA FJ, MUNOZ G. Extra-digital glomus tumor Causing thigh pain. J bone joint surg 1997 ; 79b
(1) : 104—6.
[50] MOHLER DG, LIM CK, MARTIN B. Glomus tumor of the plantar arch: A case report with magnetic resonance imaging findings. Foot Ankle int 1997 ; 18 (10):672—4.
[51] FABIANI P, BENIZRI E, MICHIELS JF. Un nouveau cas de glomangiome
Gastrique. Gastroenterol clin biol 1993 17:974-5.
[52] SHUGART R, SOULE E, JOHNSON E. Glomus tumor. Surg gynecol Obstet 1963; 117:340—3.
[53] KESKES H, TAKTAK S, MNIF J,
KESKES L, JLIDI R, TRIKI FE, ET AL. Les Tumeurs glomiques des doigts. Magreb med 1997 ;311:47—50.
[54] EKIN A, OZKAN M, KABAKLIOGLU T. Subungual glomus tumor: a different approach to diagnosis and treatment. J hand surg br 1997 ; 22:228-9.
[55] HEIM U, HÄNGGI W. Tumeurs glomiques sous-unguéales, intérêt De l’abord direct. Ann chir main 1985 4:51-4.
[56] PATER TJ, MARKS RM. Glomus tumor of the hallux : case presentation and review of the literature. Foot ankle int 2004 ; 25 : 434-7.
[57] RAYNAUD F, CALZA AM. Tumeurs cutanées de l’enfant. Emc (elsevier masson sas), pédiatrie-maladies infectieuses 1990 ;4-113-d-20.
[58] WESLEY WETHERINGTON R,
GLENN LYLE W, SANGIIEZA OP. Malignant Glomus tumor of the thumb: a case report. J hand surg 1997 ;22a :1098-102.
[59] PÉREZ DE LA FUENTE T, VEGA C,
GUTIERREZ PALACIOS A, SANCHEZ LORENZO J, GONZALEZ SARASUA J. Glomangiosarcoma of the hypothenar Eminence : a case report. Chir main 2005 ; 24:199—202.
[60] LÓPEZ-RÍOS F, RODRÍGUEZ-
PERALTO JL, CASTAÑO E, BALLESTÍN C. Glomangiosarcoma of the lower limb: a case report with a literature review. J cutanpathol. 1997 oct;24(9):571-4.
[61] OULD BNOU ML, TARHOUNI L,
BACCARI S, MAALA R, KHALFAOUI F, BAHRI H : les tumeurs glomiques de la Main. Maghreb medical, 1997, 315, 12-14.
[62] MULLER A : tumeur glomique extradigitale : une cause rare De névralgie. Ann fr annesth reanim, 1997, 16, 61-63.
[63] HEJE M, BA[G C, JENSEN SS : glomus tumours causing limb Hypoplasia. J bone joint surg (br), 1992, 74, 779-780.
PR. N. MEZIANI